撰稿:贺洁宇 审核:王翼 指导:刘幼硕
作者单位:中南大学湘雅二医院老年医学科,中南大学衰老与老年疾病研究所
联合国糖尿病日
11月14日是联合国糖尿病日,其前身是世界糖尿病日(World Diabetes Day’ WDD),由世界卫生组织和国际糖尿病联盟于1991年共同发起,其宗旨是引起全球对糖尿病的警觉和醒悟。2006年底联合国通过决议,从2007年起,将“世界糖尿病日”正式更名为“联合国糖尿病日”。今年联合国糖尿病日的宣传主题是:人人享有糖尿病健康管理。
糖尿病是造成老年衰弱/肌少症的重要原因,老年衰弱是生活自理向失能发展的过渡期,也是为延缓失能调整干预措施的最后窗口。胰岛素分为内源性和外源性,内源性胰岛素是机体内唯一降低血糖的激素,外源性胰岛素主要用于治疗糖尿病。今年适逢胰岛素发现100周年,在过去的100年里,科学家们对胰岛素有了越来越深入的认识,新型胰岛素层出不穷,使糖尿病患者的医疗照护和健康长寿有了长足进步。值此联合国糖尿病日,为您解析胰岛素对糖尿病衰弱/肌少症进展的双向作用。祝愿天下老人:夕阳里圆舞,长寿不衰弱!
—— 国家健康科普专家、中南大学衰老与老年疾病研究所所长、湘雅二医院老年医学一级主任医师/二级教授、博士生导师刘幼硕教授团队为您带来联合国糖尿病日特辑。
在过去的150年中人类预期寿命的确增加显著。然而健康寿命的增加却并不理想,这意味着“不健康生存期”过长,需改善“寿而不康”的生活状态。目前,我国老年人不健康生存(包括失能期)长达6.7年,必须立即行动,力争老而不衰提高生活质量。近年来,关于老年糖尿病患者如何精准防控衰弱失能备受关注。这些发展提出的重要问题包括:对非糖尿病老人而言,较低的血清胰岛素水平对健康长寿更有利吗?对糖尿病老人而言,又该怎样使用外源性胰岛素治疗糖尿病?如何优化诊疗流程进行分层精细管理,它有什么好处?可能使生命更健康、更长寿吗?此文献给关注老年健康长寿的人们。
问
健康增龄过程及长寿老人胰岛素分泌有何变化?
答
胰岛素由胰岛β细胞合成与分泌,胰岛素的分泌随增龄而受损,可能机制与β细胞的功能(如葡萄糖转运、氧化、KATP通道通透性降低、线粒体功能失衡、胰岛素囊泡分泌受阻等)与细胞增殖减慢有关。衰老早期胰岛素分泌增加,呈现高胰岛素血症[1,2];随衰老进程,胰岛素分泌逐渐减少,血清胰岛素水平正常或下降[3,4]。长寿老人体内有较低的血清胰岛素水平以及较好的胰岛素敏感性,提示低胰岛素血症可能对健康长寿相当重要[5,6]。
胰岛素在肝脏、骨骼肌、脂肪等组织的多种代谢中发挥作用。在肝脏中,胰岛素促进肝糖原合成与储存,抑制肝糖原分解和糖异生。在骨骼肌肉中,胰岛素刺激葡萄糖的摄取和肌糖原合成,促进蛋白合成。在脂肪组织中,胰岛素在促进葡萄糖的摄取与利用同时,促进脂肪的合成与贮存,抑制脂肪的氧化与分解。除此之外,胰岛素可通过影响下丘脑的相关受体活化或神经递质释放,调节摄食、能量稳态和肝脏糖异生[7,8]。胰岛素甚至可调节海马的空间记忆等神经功能[9]。
问
老年期胰岛素分泌相对或绝对不足对肌少症、衰弱有何危害?
答胰岛素分泌相对或绝对不足可减少肌肉蛋白质的合成代谢,这可能导致肌肉量减少并影响肌力,从而增加肌少症的发生风险,进而促进衰弱发展。
问
老年期胰岛素抵抗与肥胖型肌少症、衰弱有何相互影响?
答
胰岛素敏感性随增龄而减退。肝脏、骨骼肌和脂肪组织胰岛素抵抗是与增龄相关肥胖、2型糖尿病等代谢性疾病的主要标志[10]。胰岛素抵抗与肥胖型肌少症形成正反馈互相影响。一方面,肥胖型肌少症体脂成分增加,可增加胰岛素抵抗的风险;另一方面,胰岛素抵抗增加脂质分解,血清中游离脂肪酸水平增加,促进脂肪在肝脏及骨骼肌的异位聚积。另外,骨骼肌中的脂质沉积损害肌细胞的线粒体功能,导致肌肉质量和肌力下降[11],进而促进衰弱发展。
问
老年糖尿病对衰弱/肌少症有何危害?防控要点是什么?
答
老年糖尿病患者与非糖尿病人群相比,肌少症发病率高,衰弱的风险增加5倍[12],糖尿病是引起衰弱的重要原因。患者活动能力下降、血糖监测和管理难度增加,影响患者的预后。关注老年糖尿病患者的肌少症和衰弱问题,对老年糖尿病患者进行肌少症和衰弱的评估,并给予适当干预,除了常规管理之外,主要是增加动物蛋白质和支链氨基酸的摄入、增加抗阻运动和有氧运动、避免使用增加老年人营养不良风险和显著减轻体重的药物,将有助于改善老年糖尿病患者的预后并减少医疗支出[13,14]。
问
老年糖尿病合并衰弱的管理目标是什么?
答
2021年老年糖尿病和衰弱的专家共识推荐,根据衰弱的程度进行老年糖尿病的个体化管理:1)健康/衰弱前期/轻度衰弱的老年糖尿病患者,功能独立,预期寿命在10年以上,管理目标为逆转衰弱及控制衰弱进程,保持良好的功能状态和生活质量,预防或延缓大/微血管并发症,进一步HbA1C控制在6-7.5%,空腹血糖在5.0-7.2 mmol/L,血压在140/90 mmHg以内。2)中度衰弱的老年糖尿病患者,有2种以上的并发症,预期寿命低于10年,管理目标为预防生活质量的下降,限制小血管并发症的进展,预防糖尿病急性病发作(如低血糖)的发生,进一步HbA1C控制在8%以内,空腹血糖在6.0-8.3 mmol/L,血压在140/90 mmHg以内。3)重度衰弱患者,有严重的共病,功能依赖,预期寿命显著下降,管理目标为通过控制症状或住院时间来提高生活质量,保持仅有的功能,预防下肢肌力减退及失能,进一步HbA1C控制在8.5%以内,空腹血糖在7.0-10.0 mmol/L,血压在150/90 mmHg以内[15]。
问
胰岛素治疗对衰弱/肌少症发生发展有何影响?
答
外源性胰岛素治疗对老年糖尿病衰弱/肌少症进展具有双向作用。一方面,外源性胰岛素可通过促进葡萄糖储存和利用、蛋白质合成、增加体重、提高骨骼肌的胰岛素敏感性,有利于衰弱的防治;而另一方面,外源性的胰岛素用法不当可带来低血糖或高血糖症状,增加跌倒、谵妄等不良事件的风险,加速衰弱的发生发展。
问
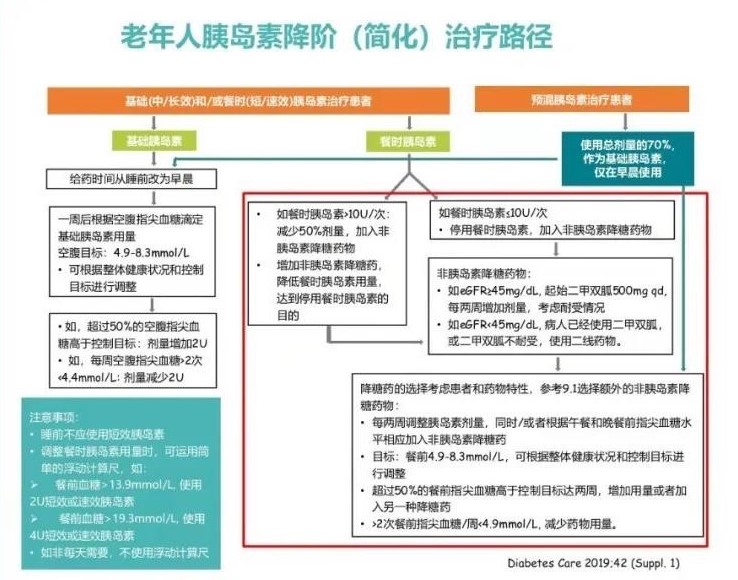
老年糖尿病怎样实施“降阶(简化)”胰岛素治疗?
答
在个体化HbA1c目标已达标前提下,复杂药物应实现降阶(简化)治疗,以达到降低低血糖风险的目的。老年人胰岛素降阶(简化)治疗路径如下图所示:
参考文献
[1] Kurauti M A, Ferreira S M, Soares G M, et al. Hyperinsulinemia is associated with increasing insulin secretion but not with decreasing insulin clearance in an age-related metabolic dysfunction mice model[J]. J Cell Physiol, 2019, 234(6): 9802-9809.
[2] Pyörälä M, Miettinen H, Laakso M, et al. Hyperinsulinemia predicts coronary heart disease risk in healthy middle-aged men: the 22-year follow-up results of the Helsinki Policemen Study[J]. Circulation, 1998, 98(5): 398-404.
[3] Garcia G V, Freeman R V, Supiano M A, et al. Glucose metabolism in older adults: a study including subjects more than 80 years of age[J]. J Am Geriatr Soc, 1997, 45(7): 813-7.
[4] Ribeiro R A, Batista T M, Coelho F M, et al. Decreased β-cell insulin secretory function in aged rats due to impaired Ca(2+) handling[J]. Exp Physiol, 2012, 97(9): 1065-73.
[5] Barbieri M, Rizzo M R, Manzella D, et al. Age-related insulin resistance: is it an obligatory finding? The lesson from healthy centenarians[J]. Diabetes Metab Res Rev, 2001, 17(1): 19-26.
[6] Templeman N M, Flibotte S, Chik J H L, et al. Reduced Circulating Insulin Enhances Insulin Sensitivity in Old Mice and Extends Lifespan[J]. Cell Rep, 2017, 20(2): 451-463.
[7] Kitamura T, Feng Y, Kitamura Y I, et al. Forkhead protein FoxO1 mediates Agrp-dependent effects of leptin on food intake[J]. Nat Med, 2006, 12(5): 534-40.
[8] Könner A C, Janoschek R, Plum L, et al. Insulin action in AgRP-expressing neurons is required for suppression of hepatic glucose production[J]. Cell Metab, 2007, 5(6): 438-49.
[9] Mcnay E C, Ong C T, Mccrimmon R J, et al. Hippocampal memory processes are modulated by insulin and high-fat-induced insulin resistance[J]. Neurobiol Learn Mem, 2010, 93(4): 546-53.
[10] Czech M P. Insulin action and resistance in obesity and type 2 diabetes[J]. Nat Med, 2017, 23(7): 804-814.
[11] Shou J, Chen P J, Xiao W H. Mechanism of increased risk of insulin resistance in aging skeletal muscle[J]. Diabetol Metab Syndr, 2020, 12: 14.
[12] Hanlon P, Nicholl B I, Jani B D, et al. Frailty and pre-frailty in middle-aged and older adults and its association with multimorbidity and mortality: a prospective analysis of 493 737 UK Biobank participants[J]. Lancet Public Health, 2018, 3(7): e323-e332.
[13] Rodriguez-Mañas L, Laosa O, Vellas B, et al. Effectiveness of a multimodal intervention in functionally impaired older people with type 2 diabetes mellitus[J]. J Cachexia Sarcopenia Muscle, 2019, 10(4): 721-733.
[14] Umegaki H. Sarcopenia and frailty in older patients with diabetes mellitus[J]. Geriatr Gerontol Int, 2016, 16(3): 293-9.
[15] Strain W D, Down S, Brown P, et al. Diabetes and Frailty: An Expert Consensus Statement on the Management of Older Adults with Type 2 Diabetes[J]. Diabetes Ther, 2021, 12(5): 1227-1247.